Qualità tecnica del processo analitico
"E' difficile fare previsioni, soprattutto sul futuro"(Yogi Berra) La qualità tecnica del processo analitico, quindi delle misure effettuate in laboratorio, è un prerequisito essenziale e ineludibile al fine di garantire che il prodotto (nel nostro caso il risultato di una analisi effettuata nel laboratorio di analisi cliniche) fornisca un valore aggiunto in termini di informazione utile ai fini della diagnosi medica. Per questo aspetto il laboratorio clinico ha un merito indiscusso: ha introdotto per primo nella sanità i procedimenti e le tecniche matematico-statistiche necessari per misurare la qualità, per trasformare l'orgoglio del laboratorio nella qualità della propria attività (un dato encomiabile, ma sfortunatamente soggettivo) in un dato misurabile e quindi oggettivo (vedremo tra poco come). Oggigiorno nel laboratorio di analisi cliniche il Controllo di Qualità (CQ) da solo non esaurisce il tema della qualità. Come abbiamo visto alla precedente pagina introduttiva al tema della qualità in laboratorio oggi siamo consapevoli del fatto che per fare qualità quello che conta è mettere a punto un sistema organizzativo globalmente orientato alla qualità, nel quale il CQ è solo una parte nell'ambito di un approccio sistemico. Ma questo non toglie nulla al valore del CQ come prerequisito di importanza basilare. Concettualmente sono due gli strumenti su cui si basa il CQ:→ il controllo di processo→ il controllo statistico di qualità CQ basato sul controllo di processo Se definiamo innanzitutto il processo come la successione degli stati attraversati da un sistema per ottenere un particolare risultato finale, in un sistema analitico il controllo di processo coincide con il controllo delle fonti della variabilità analitica, al fine di garantire un risultato finale accurato. Queste fonti sono le classiche 4m:→ manodopera (cioè il personale, che deve essere qualificato a aggiornato);→ macchine (per le quali devono essere previste appropriate tarature, calibrazioni e manutenzioni);→ materiali (che devono rispettare le specifiche richieste);→ metodi (che devono essere adeguati all'uso previsto e documentati). Il CQ basato sul controllo di processo consiste nel predisporre, applicare e documentare le azioni necessarie per mantenere sotto controllo le fonti della variabilià analitica. Di fatto corrisponde ad applicare alle 4m di cui sopra il ben noto ciclo di Deming (ciclo PDCA ovvero Plan–Do–Check–Act):P → pianificare gli interventiD → eseguire il programma di interventi pianificatoC → verificare cosa accade, raccogliere i risultati, documentarliA → predispore le azioni necessarie per il miglioramento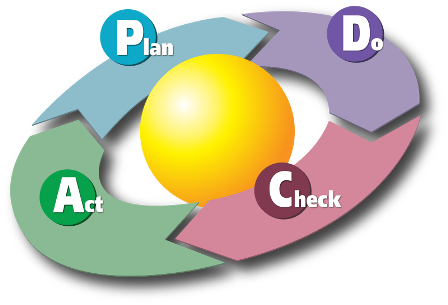 Il CQ basato sul controllo di processo si applica a tutte le analisi di laboratorio. Tuttavia è anche l’unico tipo di CQ applicabile alle analisi che non prevedono un risultato numerico (come le analisi di microbiologia, di citogenetica, di anatomia patologica), cioè alle analisi alle quali non è applicabile il CQ basato sul controllo statistico di qualità che vedremo tra poco. Nel CQ basato sul controllo di processo il punto delicato è rappresentato dagli indicatori scelti per monitorare il processo analitico, e mediante i quali si riconoscono nelle diverse componenti/stati del processo gli scostamenti dal valore atteso in grado di influenzare il risultato delle analisi. Esempi di CQ basato sul controllo di processo sono rappresentati:→ dalla verifica della corretta esecuzione del test mediante un controllo associato ad ogni singolo test (come ad esempio nei dispositivi per auto-analisi disponibili in farmacia);→ dal controllo eseguito da due operatori indipendenti sullo stesso materiale (come la lettura al microscopio dei preparati da parte di due diversi operatori);→ dalla ripetizione dell'analisi da parte di due operatori indipendenti su differenti aliquote di materiale (come avviene ad esempio in citogenetica).Un esempio di applicazione dei principi del CQ basato sul controllo di processo si trova nelle sezioni dedicate alla microbiologia e all’anatomia patologica del documento “Il controllo di qualità interno nel servizio di medicina di laboratorio” allegato al DDG 32856 della Regione Lombardia (per inciso nel documento non compare alcun riferimento alla citogenetica e genetica medica). CQ basato sul controllo statistico di qualità Nel caso in cui i risultati di una analisi di laboratorio siano esprimibili in forma numerica (per la precisione in una scala numerica continua) si può applicare il controllo statistico di qualità. Che poi è la forma di controllo che il laboratorio di analisi cliniche ha mutuato dall'industria e che, come abbiamo visto nella precedente pagina introduttiva al tema della qualità in laboratorio, nella parte dedicata al Sistema di Gestione per la Qualità, è nata per prima, precedendo di decenni la moderna visione sistemica della qualità della quale ora fa parte. Il razionale di questo approccio è basato sul fatto che l'errore di misura è distribuito in modo gaussiano. Pertanto è possibile, una volta stabilito un intervallo di tollerenza massimo per l'errore di misura, utilizzare le proprietà della distribuzione gaussiana per costruire le regole necessarie per rilevare se l'errore di misura rientra nei limiti prestabiliti, o se li eccede. Per le definizioni di base e un minimo di inquadramento del problema rimando alla mia nota “Sbagli, errori e distribuzione gaussiana”. Ma in un sistema analitico che esegue molte migliaia di analisi al giorno come è possibile prevedere se l’errore di misura nella analisi del prossimo campione di sangue risulterà all’interno dell'intervallo di tolleranza prestabilito? Rispetto al controllo di qualità dell'industria il controllo di qualità nel laboratorio di analisi cliniche richiede un salto logico. Nel caso dell'industria, infatti, si tratta di:1) stabilire le caratteristiche del prodotto (per esempio un contenitore deve contenere un litro di latte);2) stabilire il livello di tolleranza del prodotto (per esempio il contenitore deve contenere un litro con una tolleranza di più o meno il 3%, quindi tra 970 e 1030 millilitri);3) stabilire la frazione di prodotti che deve essere estratta a campione dal processo produttivo, ed esaminata al fine di misurarne il contenuto (per esempio l’1% dei contenitori);4) stabilire l'obiettivo di qualità, inteso come la frazione di prodotti che devono rientrare nel livello di tolleranza (per esempio il 95% dei contenitori);5) estrarre dal processo produttivo la frazione prestabilita di prodotto (nell'esempio l’1% dei contenitori);6) analizzare il prodotto (n questo caso il contenuto in millilitri dei contenitori campionati);7) confrontare la frazione di prodotto che rientra nel livello di tolleranza con l'obiettivo di qualità;8) se la frazione di prodotto che rientra nel livello di tolleranza è inferiore all'obiettivo di qualità, attivare le azioni correttive necessarie sul processo di produzione. Nel caso del laboratorio clinico invece ogni campione/paziente è diverso dall'altro. Quindi la sequenza sopra riportata semplicemente crolla a livello logico. Ma allora cosa possimo fare? Ed ecco l'idea:1) stabilire le caratteristiche di un materiale utilizzato come CQ (per esempio un siero contiene cento milligrammi per decilitro di glucosio, misurati per pesata e diluizione);2) stabilire il livello di tolleranza nella misura effettuata sul materiale utilizzato come CQ (per esempio la misura effettuata sul materiale utilizzato come controllo di qualità deve fornire un risultato di cento milligrammi per decilitro di glucosio con una tolleranza di più o meno il 3%, quindi tra 97 e 103 milligrammi per decilitro);3) stabilire la frazione di campioni di CQ che devono essere inseriti nel processo analitico, ed esaminati al fine di misurarne il contenuto (per esempio il 5%);4) stabilire l'obiettivo di qualità, inteso come la frazione di campioni di CQ che devono rientrare nel livello di tolleranza (per esempio il 95%);5) inserire processo analitico la frazione prestabilita di campioni di CQ (nell'esempio il 5% dei campioni da analizzare);6) analizzarne i campioni di CQ;7) confrontare la frazione di campioni di CQ che rientra nel livello di tolleranza con l'obiettivo di qualità. Si ottiene così, su un materiale utilizzato come controllo di qualità, una stima della qualità del procedimento di misura, stima che può essere utilizzata per fare una inferenza sulla qualità dei risultati ottenti sui materiali del pazienti (sangue, siero, plasma o altro). Data una distribuziona gaussiana dell'errore di misura, se su un campione di controllo si ottiene una deviazione standard pari al 3% della media, possiamo affermare che una dispersione della stessa entità caratterizza ogni singolo risultato di ogni singolo paziente per la specifica analisi;8) se la frazione di controlli che rientra nel livello di tolleranza è inferiore all'obiettivo di qualità, attivare le azioni correttive necessarie sul processo analitico. In realtà quello sopra è uno schema semplificato per illustrare il concetto, e le cose sono in effetti molto più complesse. Basta ad esempio dire che l’aggiunta per pesata di una molecola ad una matrice (per esempio siero) è possibile solo in casi limitati, e questo determina il problema delle modalità con le quali assegnare i valori di concentrazione ai materiali utilizzati per il CQ. Inoltre i materiali, per esempio sieri, utilizzati come campioni di CQ non sono materiali biologici freschi, ma sono materiali trattati (per esempio liofilizzati) per assicurarne una lunga conservazione, e questo può determinare nei materiali di controllo comportamenti difformi rispetto a quelli dei sieri freschi dei pazienti (un problema noto come “mancanza di commutabilità”). Per un approfondimento di questi temi riporto (anche se è un pò datato, rimane sostanzialmente valido) il documento sul “Controllo di qualità nel laboratorio clinico” pubblicato nel 1995 con alcuni colleghi della SIBioC. La parte relativa alla biochimica clinica, che fa la parte del leone nell’utilizzo del CQ basato sul controllo statistico di qualità, è trattata ampiamente nel già citato documento su “Il controllo di qualità interno nel servizio di medicina di laboratorio” allegato al DDG 32856 della Regione Lombardia. Se quello sopra riportato lo potremmo definire come l'approccio classico al controllo di qualità nel laboratorio clinico, in realtà con il passare degli anni gli strumenti di gestione si sono progressivamente affinati. Così a metà degli anni '90 sono comparse le carte OPS, che consentono, sulla base della modellizzazione dell'errore analitico proposta da J. O. Westgard, di adattare le regole di controllo alle specifiche situazioni analitiche. Nell'area di download trovate il programma per PC che avevo scritto allora. Per un approfondimento del tema potete consultare direttamente il documento “Le funzioni di potenza e le carte OPS” che avevo preparato per illustrare il programma, che contiene una spiegazione delle basi teoriche e delle tecniche impiegate. Noto fino al 2005 come NCCLS (National Committee for Clinical Laboratory Standards), l'attuale CLSI (Clinical and Laboratory Standards Institute) è il massimo riferimento istituzionale anche nel campo del CQ. Le linee guida per l'implementazione dell'approccio al CQ introdotto da Westgard le potete trovare nel documento del CLSI: C24-A3 Statistical Quality Control for Quantitative Measurement Procedures: Principles and Definitions; Approved Guideline — Third Edition (2006). Un approccio ancora più attuale, è quello del CQ basato sulla gestione del rischio, la cui linea guida è stata pubblicata nel 2011 dal CLSI:EP23-A Laboratory Quality Control Based on Risk Management; Approved Guideline (2011). Il CQ basato sulla gestione del rischio, secondo quanto afferma Westgard, è destinato (almeno negli USA) a portare rapidamente alla cessazione dell’utilizzo di quella forma di CQ che da noi è nota come VEQ (Valutazione Esterna della Qualità) come strumento per il controllo della qualità analitica. Personalmente ritengo che anche noi dovremmo seguire questa strada. Registrandovi al sito di J. O. Westgard (la registrazione è gratuita) potete accedere alla migliore raccolta di documenti e articoli sul tema del CQ disponibile sul web. Va da sè che se in un laboratorio di analisi cliniche (per esempio) i campioni di due pazienti possono essere scambiati, o se un risultato può essere trascritto in modo errato, la qualità analitica dedotta dal controllo statistico di qualità può essere grossolanamente inapplicabile ad uno specifico campione. Per questo il controllo di qualità è un buon indicatore della qualità dei risultati ottenuti sui materiali biologici dei pazienti solamente se inserito in un contesto organizzativo che assicura il controllo di tutte le variabili di processo. Così oggi in un moderno laboratorio clinico due campioni non possono essere scambiati in quanto il contenitore identificato al momento del prelievo con un codice a barre viene riconosciuto automaticamente e senza possibilità di sbagli dallo strumento che effettua l'analisi. E il relativo risultato non può essere trascritto in modo errato, perché dallo strumento viene trasferito direttamente nel referto. Nel corso di un paio di decenni controllo di qualità e gestione del contesto organizzativo fortunatamente sono andati evolvendo molto in fretta e congiuntamente, e assicurano oggigiorno risultati delle analisi di laboratorio affidabili e disponibili in tempi molto rapidi. ******************************** Nota: il diagramma PDCA è tratto da Karn G. Bulsuk (http://www.bulsuk.com)
Il CQ basato sul controllo di processo si applica a tutte le analisi di laboratorio. Tuttavia è anche l’unico tipo di CQ applicabile alle analisi che non prevedono un risultato numerico (come le analisi di microbiologia, di citogenetica, di anatomia patologica), cioè alle analisi alle quali non è applicabile il CQ basato sul controllo statistico di qualità che vedremo tra poco. Nel CQ basato sul controllo di processo il punto delicato è rappresentato dagli indicatori scelti per monitorare il processo analitico, e mediante i quali si riconoscono nelle diverse componenti/stati del processo gli scostamenti dal valore atteso in grado di influenzare il risultato delle analisi. Esempi di CQ basato sul controllo di processo sono rappresentati:→ dalla verifica della corretta esecuzione del test mediante un controllo associato ad ogni singolo test (come ad esempio nei dispositivi per auto-analisi disponibili in farmacia);→ dal controllo eseguito da due operatori indipendenti sullo stesso materiale (come la lettura al microscopio dei preparati da parte di due diversi operatori);→ dalla ripetizione dell'analisi da parte di due operatori indipendenti su differenti aliquote di materiale (come avviene ad esempio in citogenetica).Un esempio di applicazione dei principi del CQ basato sul controllo di processo si trova nelle sezioni dedicate alla microbiologia e all’anatomia patologica del documento “Il controllo di qualità interno nel servizio di medicina di laboratorio” allegato al DDG 32856 della Regione Lombardia (per inciso nel documento non compare alcun riferimento alla citogenetica e genetica medica). CQ basato sul controllo statistico di qualità Nel caso in cui i risultati di una analisi di laboratorio siano esprimibili in forma numerica (per la precisione in una scala numerica continua) si può applicare il controllo statistico di qualità. Che poi è la forma di controllo che il laboratorio di analisi cliniche ha mutuato dall'industria e che, come abbiamo visto nella precedente pagina introduttiva al tema della qualità in laboratorio, nella parte dedicata al Sistema di Gestione per la Qualità, è nata per prima, precedendo di decenni la moderna visione sistemica della qualità della quale ora fa parte. Il razionale di questo approccio è basato sul fatto che l'errore di misura è distribuito in modo gaussiano. Pertanto è possibile, una volta stabilito un intervallo di tollerenza massimo per l'errore di misura, utilizzare le proprietà della distribuzione gaussiana per costruire le regole necessarie per rilevare se l'errore di misura rientra nei limiti prestabiliti, o se li eccede. Per le definizioni di base e un minimo di inquadramento del problema rimando alla mia nota “Sbagli, errori e distribuzione gaussiana”. Ma in un sistema analitico che esegue molte migliaia di analisi al giorno come è possibile prevedere se l’errore di misura nella analisi del prossimo campione di sangue risulterà all’interno dell'intervallo di tolleranza prestabilito? Rispetto al controllo di qualità dell'industria il controllo di qualità nel laboratorio di analisi cliniche richiede un salto logico. Nel caso dell'industria, infatti, si tratta di:1) stabilire le caratteristiche del prodotto (per esempio un contenitore deve contenere un litro di latte);2) stabilire il livello di tolleranza del prodotto (per esempio il contenitore deve contenere un litro con una tolleranza di più o meno il 3%, quindi tra 970 e 1030 millilitri);3) stabilire la frazione di prodotti che deve essere estratta a campione dal processo produttivo, ed esaminata al fine di misurarne il contenuto (per esempio l’1% dei contenitori);4) stabilire l'obiettivo di qualità, inteso come la frazione di prodotti che devono rientrare nel livello di tolleranza (per esempio il 95% dei contenitori);5) estrarre dal processo produttivo la frazione prestabilita di prodotto (nell'esempio l’1% dei contenitori);6) analizzare il prodotto (n questo caso il contenuto in millilitri dei contenitori campionati);7) confrontare la frazione di prodotto che rientra nel livello di tolleranza con l'obiettivo di qualità;8) se la frazione di prodotto che rientra nel livello di tolleranza è inferiore all'obiettivo di qualità, attivare le azioni correttive necessarie sul processo di produzione. Nel caso del laboratorio clinico invece ogni campione/paziente è diverso dall'altro. Quindi la sequenza sopra riportata semplicemente crolla a livello logico. Ma allora cosa possimo fare? Ed ecco l'idea:1) stabilire le caratteristiche di un materiale utilizzato come CQ (per esempio un siero contiene cento milligrammi per decilitro di glucosio, misurati per pesata e diluizione);2) stabilire il livello di tolleranza nella misura effettuata sul materiale utilizzato come CQ (per esempio la misura effettuata sul materiale utilizzato come controllo di qualità deve fornire un risultato di cento milligrammi per decilitro di glucosio con una tolleranza di più o meno il 3%, quindi tra 97 e 103 milligrammi per decilitro);3) stabilire la frazione di campioni di CQ che devono essere inseriti nel processo analitico, ed esaminati al fine di misurarne il contenuto (per esempio il 5%);4) stabilire l'obiettivo di qualità, inteso come la frazione di campioni di CQ che devono rientrare nel livello di tolleranza (per esempio il 95%);5) inserire processo analitico la frazione prestabilita di campioni di CQ (nell'esempio il 5% dei campioni da analizzare);6) analizzarne i campioni di CQ;7) confrontare la frazione di campioni di CQ che rientra nel livello di tolleranza con l'obiettivo di qualità. Si ottiene così, su un materiale utilizzato come controllo di qualità, una stima della qualità del procedimento di misura, stima che può essere utilizzata per fare una inferenza sulla qualità dei risultati ottenti sui materiali del pazienti (sangue, siero, plasma o altro). Data una distribuziona gaussiana dell'errore di misura, se su un campione di controllo si ottiene una deviazione standard pari al 3% della media, possiamo affermare che una dispersione della stessa entità caratterizza ogni singolo risultato di ogni singolo paziente per la specifica analisi;8) se la frazione di controlli che rientra nel livello di tolleranza è inferiore all'obiettivo di qualità, attivare le azioni correttive necessarie sul processo analitico. In realtà quello sopra è uno schema semplificato per illustrare il concetto, e le cose sono in effetti molto più complesse. Basta ad esempio dire che l’aggiunta per pesata di una molecola ad una matrice (per esempio siero) è possibile solo in casi limitati, e questo determina il problema delle modalità con le quali assegnare i valori di concentrazione ai materiali utilizzati per il CQ. Inoltre i materiali, per esempio sieri, utilizzati come campioni di CQ non sono materiali biologici freschi, ma sono materiali trattati (per esempio liofilizzati) per assicurarne una lunga conservazione, e questo può determinare nei materiali di controllo comportamenti difformi rispetto a quelli dei sieri freschi dei pazienti (un problema noto come “mancanza di commutabilità”). Per un approfondimento di questi temi riporto (anche se è un pò datato, rimane sostanzialmente valido) il documento sul “Controllo di qualità nel laboratorio clinico” pubblicato nel 1995 con alcuni colleghi della SIBioC. La parte relativa alla biochimica clinica, che fa la parte del leone nell’utilizzo del CQ basato sul controllo statistico di qualità, è trattata ampiamente nel già citato documento su “Il controllo di qualità interno nel servizio di medicina di laboratorio” allegato al DDG 32856 della Regione Lombardia. Se quello sopra riportato lo potremmo definire come l'approccio classico al controllo di qualità nel laboratorio clinico, in realtà con il passare degli anni gli strumenti di gestione si sono progressivamente affinati. Così a metà degli anni '90 sono comparse le carte OPS, che consentono, sulla base della modellizzazione dell'errore analitico proposta da J. O. Westgard, di adattare le regole di controllo alle specifiche situazioni analitiche. Nell'area di download trovate il programma per PC che avevo scritto allora. Per un approfondimento del tema potete consultare direttamente il documento “Le funzioni di potenza e le carte OPS” che avevo preparato per illustrare il programma, che contiene una spiegazione delle basi teoriche e delle tecniche impiegate. Noto fino al 2005 come NCCLS (National Committee for Clinical Laboratory Standards), l'attuale CLSI (Clinical and Laboratory Standards Institute) è il massimo riferimento istituzionale anche nel campo del CQ. Le linee guida per l'implementazione dell'approccio al CQ introdotto da Westgard le potete trovare nel documento del CLSI: C24-A3 Statistical Quality Control for Quantitative Measurement Procedures: Principles and Definitions; Approved Guideline — Third Edition (2006). Un approccio ancora più attuale, è quello del CQ basato sulla gestione del rischio, la cui linea guida è stata pubblicata nel 2011 dal CLSI:EP23-A Laboratory Quality Control Based on Risk Management; Approved Guideline (2011). Il CQ basato sulla gestione del rischio, secondo quanto afferma Westgard, è destinato (almeno negli USA) a portare rapidamente alla cessazione dell’utilizzo di quella forma di CQ che da noi è nota come VEQ (Valutazione Esterna della Qualità) come strumento per il controllo della qualità analitica. Personalmente ritengo che anche noi dovremmo seguire questa strada. Registrandovi al sito di J. O. Westgard (la registrazione è gratuita) potete accedere alla migliore raccolta di documenti e articoli sul tema del CQ disponibile sul web. Va da sè che se in un laboratorio di analisi cliniche (per esempio) i campioni di due pazienti possono essere scambiati, o se un risultato può essere trascritto in modo errato, la qualità analitica dedotta dal controllo statistico di qualità può essere grossolanamente inapplicabile ad uno specifico campione. Per questo il controllo di qualità è un buon indicatore della qualità dei risultati ottenuti sui materiali biologici dei pazienti solamente se inserito in un contesto organizzativo che assicura il controllo di tutte le variabili di processo. Così oggi in un moderno laboratorio clinico due campioni non possono essere scambiati in quanto il contenitore identificato al momento del prelievo con un codice a barre viene riconosciuto automaticamente e senza possibilità di sbagli dallo strumento che effettua l'analisi. E il relativo risultato non può essere trascritto in modo errato, perché dallo strumento viene trasferito direttamente nel referto. Nel corso di un paio di decenni controllo di qualità e gestione del contesto organizzativo fortunatamente sono andati evolvendo molto in fretta e congiuntamente, e assicurano oggigiorno risultati delle analisi di laboratorio affidabili e disponibili in tempi molto rapidi. ******************************** Nota: il diagramma PDCA è tratto da Karn G. Bulsuk (http://www.bulsuk.com)
 Il CQ basato sul controllo di processo si applica a tutte le analisi di laboratorio. Tuttavia è anche l’unico tipo di CQ applicabile alle analisi che non prevedono un risultato numerico (come le analisi di microbiologia, di citogenetica, di anatomia patologica), cioè alle analisi alle quali non è applicabile il CQ basato sul controllo statistico di qualità che vedremo tra poco. Nel CQ basato sul controllo di processo il punto delicato è rappresentato dagli indicatori scelti per monitorare il processo analitico, e mediante i quali si riconoscono nelle diverse componenti/stati del processo gli scostamenti dal valore atteso in grado di influenzare il risultato delle analisi. Esempi di CQ basato sul controllo di processo sono rappresentati:→ dalla verifica della corretta esecuzione del test mediante un controllo associato ad ogni singolo test (come ad esempio nei dispositivi per auto-analisi disponibili in farmacia);→ dal controllo eseguito da due operatori indipendenti sullo stesso materiale (come la lettura al microscopio dei preparati da parte di due diversi operatori);→ dalla ripetizione dell'analisi da parte di due operatori indipendenti su differenti aliquote di materiale (come avviene ad esempio in citogenetica).Un esempio di applicazione dei principi del CQ basato sul controllo di processo si trova nelle sezioni dedicate alla microbiologia e all’anatomia patologica del documento “Il controllo di qualità interno nel servizio di medicina di laboratorio” allegato al DDG 32856 della Regione Lombardia (per inciso nel documento non compare alcun riferimento alla citogenetica e genetica medica). CQ basato sul controllo statistico di qualità Nel caso in cui i risultati di una analisi di laboratorio siano esprimibili in forma numerica (per la precisione in una scala numerica continua) si può applicare il controllo statistico di qualità. Che poi è la forma di controllo che il laboratorio di analisi cliniche ha mutuato dall'industria e che, come abbiamo visto nella precedente pagina introduttiva al tema della qualità in laboratorio, nella parte dedicata al Sistema di Gestione per la Qualità, è nata per prima, precedendo di decenni la moderna visione sistemica della qualità della quale ora fa parte. Il razionale di questo approccio è basato sul fatto che l'errore di misura è distribuito in modo gaussiano. Pertanto è possibile, una volta stabilito un intervallo di tollerenza massimo per l'errore di misura, utilizzare le proprietà della distribuzione gaussiana per costruire le regole necessarie per rilevare se l'errore di misura rientra nei limiti prestabiliti, o se li eccede. Per le definizioni di base e un minimo di inquadramento del problema rimando alla mia nota “Sbagli, errori e distribuzione gaussiana”. Ma in un sistema analitico che esegue molte migliaia di analisi al giorno come è possibile prevedere se l’errore di misura nella analisi del prossimo campione di sangue risulterà all’interno dell'intervallo di tolleranza prestabilito? Rispetto al controllo di qualità dell'industria il controllo di qualità nel laboratorio di analisi cliniche richiede un salto logico. Nel caso dell'industria, infatti, si tratta di:1) stabilire le caratteristiche del prodotto (per esempio un contenitore deve contenere un litro di latte);2) stabilire il livello di tolleranza del prodotto (per esempio il contenitore deve contenere un litro con una tolleranza di più o meno il 3%, quindi tra 970 e 1030 millilitri);3) stabilire la frazione di prodotti che deve essere estratta a campione dal processo produttivo, ed esaminata al fine di misurarne il contenuto (per esempio l’1% dei contenitori);4) stabilire l'obiettivo di qualità, inteso come la frazione di prodotti che devono rientrare nel livello di tolleranza (per esempio il 95% dei contenitori);5) estrarre dal processo produttivo la frazione prestabilita di prodotto (nell'esempio l’1% dei contenitori);6) analizzare il prodotto (n questo caso il contenuto in millilitri dei contenitori campionati);7) confrontare la frazione di prodotto che rientra nel livello di tolleranza con l'obiettivo di qualità;8) se la frazione di prodotto che rientra nel livello di tolleranza è inferiore all'obiettivo di qualità, attivare le azioni correttive necessarie sul processo di produzione. Nel caso del laboratorio clinico invece ogni campione/paziente è diverso dall'altro. Quindi la sequenza sopra riportata semplicemente crolla a livello logico. Ma allora cosa possimo fare? Ed ecco l'idea:1) stabilire le caratteristiche di un materiale utilizzato come CQ (per esempio un siero contiene cento milligrammi per decilitro di glucosio, misurati per pesata e diluizione);2) stabilire il livello di tolleranza nella misura effettuata sul materiale utilizzato come CQ (per esempio la misura effettuata sul materiale utilizzato come controllo di qualità deve fornire un risultato di cento milligrammi per decilitro di glucosio con una tolleranza di più o meno il 3%, quindi tra 97 e 103 milligrammi per decilitro);3) stabilire la frazione di campioni di CQ che devono essere inseriti nel processo analitico, ed esaminati al fine di misurarne il contenuto (per esempio il 5%);4) stabilire l'obiettivo di qualità, inteso come la frazione di campioni di CQ che devono rientrare nel livello di tolleranza (per esempio il 95%);5) inserire processo analitico la frazione prestabilita di campioni di CQ (nell'esempio il 5% dei campioni da analizzare);6) analizzarne i campioni di CQ;7) confrontare la frazione di campioni di CQ che rientra nel livello di tolleranza con l'obiettivo di qualità. Si ottiene così, su un materiale utilizzato come controllo di qualità, una stima della qualità del procedimento di misura, stima che può essere utilizzata per fare una inferenza sulla qualità dei risultati ottenti sui materiali del pazienti (sangue, siero, plasma o altro). Data una distribuziona gaussiana dell'errore di misura, se su un campione di controllo si ottiene una deviazione standard pari al 3% della media, possiamo affermare che una dispersione della stessa entità caratterizza ogni singolo risultato di ogni singolo paziente per la specifica analisi;8) se la frazione di controlli che rientra nel livello di tolleranza è inferiore all'obiettivo di qualità, attivare le azioni correttive necessarie sul processo analitico. In realtà quello sopra è uno schema semplificato per illustrare il concetto, e le cose sono in effetti molto più complesse. Basta ad esempio dire che l’aggiunta per pesata di una molecola ad una matrice (per esempio siero) è possibile solo in casi limitati, e questo determina il problema delle modalità con le quali assegnare i valori di concentrazione ai materiali utilizzati per il CQ. Inoltre i materiali, per esempio sieri, utilizzati come campioni di CQ non sono materiali biologici freschi, ma sono materiali trattati (per esempio liofilizzati) per assicurarne una lunga conservazione, e questo può determinare nei materiali di controllo comportamenti difformi rispetto a quelli dei sieri freschi dei pazienti (un problema noto come “mancanza di commutabilità”). Per un approfondimento di questi temi riporto (anche se è un pò datato, rimane sostanzialmente valido) il documento sul “Controllo di qualità nel laboratorio clinico” pubblicato nel 1995 con alcuni colleghi della SIBioC. La parte relativa alla biochimica clinica, che fa la parte del leone nell’utilizzo del CQ basato sul controllo statistico di qualità, è trattata ampiamente nel già citato documento su “Il controllo di qualità interno nel servizio di medicina di laboratorio” allegato al DDG 32856 della Regione Lombardia. Se quello sopra riportato lo potremmo definire come l'approccio classico al controllo di qualità nel laboratorio clinico, in realtà con il passare degli anni gli strumenti di gestione si sono progressivamente affinati. Così a metà degli anni '90 sono comparse le carte OPS, che consentono, sulla base della modellizzazione dell'errore analitico proposta da J. O. Westgard, di adattare le regole di controllo alle specifiche situazioni analitiche. Nell'area di download trovate il programma per PC che avevo scritto allora. Per un approfondimento del tema potete consultare direttamente il documento “Le funzioni di potenza e le carte OPS” che avevo preparato per illustrare il programma, che contiene una spiegazione delle basi teoriche e delle tecniche impiegate. Noto fino al 2005 come NCCLS (National Committee for Clinical Laboratory Standards), l'attuale CLSI (Clinical and Laboratory Standards Institute) è il massimo riferimento istituzionale anche nel campo del CQ. Le linee guida per l'implementazione dell'approccio al CQ introdotto da Westgard le potete trovare nel documento del CLSI: C24-A3 Statistical Quality Control for Quantitative Measurement Procedures: Principles and Definitions; Approved Guideline — Third Edition (2006). Un approccio ancora più attuale, è quello del CQ basato sulla gestione del rischio, la cui linea guida è stata pubblicata nel 2011 dal CLSI:EP23-A Laboratory Quality Control Based on Risk Management; Approved Guideline (2011). Il CQ basato sulla gestione del rischio, secondo quanto afferma Westgard, è destinato (almeno negli USA) a portare rapidamente alla cessazione dell’utilizzo di quella forma di CQ che da noi è nota come VEQ (Valutazione Esterna della Qualità) come strumento per il controllo della qualità analitica. Personalmente ritengo che anche noi dovremmo seguire questa strada. Registrandovi al sito di J. O. Westgard (la registrazione è gratuita) potete accedere alla migliore raccolta di documenti e articoli sul tema del CQ disponibile sul web. Va da sè che se in un laboratorio di analisi cliniche (per esempio) i campioni di due pazienti possono essere scambiati, o se un risultato può essere trascritto in modo errato, la qualità analitica dedotta dal controllo statistico di qualità può essere grossolanamente inapplicabile ad uno specifico campione. Per questo il controllo di qualità è un buon indicatore della qualità dei risultati ottenuti sui materiali biologici dei pazienti solamente se inserito in un contesto organizzativo che assicura il controllo di tutte le variabili di processo. Così oggi in un moderno laboratorio clinico due campioni non possono essere scambiati in quanto il contenitore identificato al momento del prelievo con un codice a barre viene riconosciuto automaticamente e senza possibilità di sbagli dallo strumento che effettua l'analisi. E il relativo risultato non può essere trascritto in modo errato, perché dallo strumento viene trasferito direttamente nel referto. Nel corso di un paio di decenni controllo di qualità e gestione del contesto organizzativo fortunatamente sono andati evolvendo molto in fretta e congiuntamente, e assicurano oggigiorno risultati delle analisi di laboratorio affidabili e disponibili in tempi molto rapidi. ******************************** Nota: il diagramma PDCA è tratto da Karn G. Bulsuk (http://www.bulsuk.com)
Il CQ basato sul controllo di processo si applica a tutte le analisi di laboratorio. Tuttavia è anche l’unico tipo di CQ applicabile alle analisi che non prevedono un risultato numerico (come le analisi di microbiologia, di citogenetica, di anatomia patologica), cioè alle analisi alle quali non è applicabile il CQ basato sul controllo statistico di qualità che vedremo tra poco. Nel CQ basato sul controllo di processo il punto delicato è rappresentato dagli indicatori scelti per monitorare il processo analitico, e mediante i quali si riconoscono nelle diverse componenti/stati del processo gli scostamenti dal valore atteso in grado di influenzare il risultato delle analisi. Esempi di CQ basato sul controllo di processo sono rappresentati:→ dalla verifica della corretta esecuzione del test mediante un controllo associato ad ogni singolo test (come ad esempio nei dispositivi per auto-analisi disponibili in farmacia);→ dal controllo eseguito da due operatori indipendenti sullo stesso materiale (come la lettura al microscopio dei preparati da parte di due diversi operatori);→ dalla ripetizione dell'analisi da parte di due operatori indipendenti su differenti aliquote di materiale (come avviene ad esempio in citogenetica).Un esempio di applicazione dei principi del CQ basato sul controllo di processo si trova nelle sezioni dedicate alla microbiologia e all’anatomia patologica del documento “Il controllo di qualità interno nel servizio di medicina di laboratorio” allegato al DDG 32856 della Regione Lombardia (per inciso nel documento non compare alcun riferimento alla citogenetica e genetica medica). CQ basato sul controllo statistico di qualità Nel caso in cui i risultati di una analisi di laboratorio siano esprimibili in forma numerica (per la precisione in una scala numerica continua) si può applicare il controllo statistico di qualità. Che poi è la forma di controllo che il laboratorio di analisi cliniche ha mutuato dall'industria e che, come abbiamo visto nella precedente pagina introduttiva al tema della qualità in laboratorio, nella parte dedicata al Sistema di Gestione per la Qualità, è nata per prima, precedendo di decenni la moderna visione sistemica della qualità della quale ora fa parte. Il razionale di questo approccio è basato sul fatto che l'errore di misura è distribuito in modo gaussiano. Pertanto è possibile, una volta stabilito un intervallo di tollerenza massimo per l'errore di misura, utilizzare le proprietà della distribuzione gaussiana per costruire le regole necessarie per rilevare se l'errore di misura rientra nei limiti prestabiliti, o se li eccede. Per le definizioni di base e un minimo di inquadramento del problema rimando alla mia nota “Sbagli, errori e distribuzione gaussiana”. Ma in un sistema analitico che esegue molte migliaia di analisi al giorno come è possibile prevedere se l’errore di misura nella analisi del prossimo campione di sangue risulterà all’interno dell'intervallo di tolleranza prestabilito? Rispetto al controllo di qualità dell'industria il controllo di qualità nel laboratorio di analisi cliniche richiede un salto logico. Nel caso dell'industria, infatti, si tratta di:1) stabilire le caratteristiche del prodotto (per esempio un contenitore deve contenere un litro di latte);2) stabilire il livello di tolleranza del prodotto (per esempio il contenitore deve contenere un litro con una tolleranza di più o meno il 3%, quindi tra 970 e 1030 millilitri);3) stabilire la frazione di prodotti che deve essere estratta a campione dal processo produttivo, ed esaminata al fine di misurarne il contenuto (per esempio l’1% dei contenitori);4) stabilire l'obiettivo di qualità, inteso come la frazione di prodotti che devono rientrare nel livello di tolleranza (per esempio il 95% dei contenitori);5) estrarre dal processo produttivo la frazione prestabilita di prodotto (nell'esempio l’1% dei contenitori);6) analizzare il prodotto (n questo caso il contenuto in millilitri dei contenitori campionati);7) confrontare la frazione di prodotto che rientra nel livello di tolleranza con l'obiettivo di qualità;8) se la frazione di prodotto che rientra nel livello di tolleranza è inferiore all'obiettivo di qualità, attivare le azioni correttive necessarie sul processo di produzione. Nel caso del laboratorio clinico invece ogni campione/paziente è diverso dall'altro. Quindi la sequenza sopra riportata semplicemente crolla a livello logico. Ma allora cosa possimo fare? Ed ecco l'idea:1) stabilire le caratteristiche di un materiale utilizzato come CQ (per esempio un siero contiene cento milligrammi per decilitro di glucosio, misurati per pesata e diluizione);2) stabilire il livello di tolleranza nella misura effettuata sul materiale utilizzato come CQ (per esempio la misura effettuata sul materiale utilizzato come controllo di qualità deve fornire un risultato di cento milligrammi per decilitro di glucosio con una tolleranza di più o meno il 3%, quindi tra 97 e 103 milligrammi per decilitro);3) stabilire la frazione di campioni di CQ che devono essere inseriti nel processo analitico, ed esaminati al fine di misurarne il contenuto (per esempio il 5%);4) stabilire l'obiettivo di qualità, inteso come la frazione di campioni di CQ che devono rientrare nel livello di tolleranza (per esempio il 95%);5) inserire processo analitico la frazione prestabilita di campioni di CQ (nell'esempio il 5% dei campioni da analizzare);6) analizzarne i campioni di CQ;7) confrontare la frazione di campioni di CQ che rientra nel livello di tolleranza con l'obiettivo di qualità. Si ottiene così, su un materiale utilizzato come controllo di qualità, una stima della qualità del procedimento di misura, stima che può essere utilizzata per fare una inferenza sulla qualità dei risultati ottenti sui materiali del pazienti (sangue, siero, plasma o altro). Data una distribuziona gaussiana dell'errore di misura, se su un campione di controllo si ottiene una deviazione standard pari al 3% della media, possiamo affermare che una dispersione della stessa entità caratterizza ogni singolo risultato di ogni singolo paziente per la specifica analisi;8) se la frazione di controlli che rientra nel livello di tolleranza è inferiore all'obiettivo di qualità, attivare le azioni correttive necessarie sul processo analitico. In realtà quello sopra è uno schema semplificato per illustrare il concetto, e le cose sono in effetti molto più complesse. Basta ad esempio dire che l’aggiunta per pesata di una molecola ad una matrice (per esempio siero) è possibile solo in casi limitati, e questo determina il problema delle modalità con le quali assegnare i valori di concentrazione ai materiali utilizzati per il CQ. Inoltre i materiali, per esempio sieri, utilizzati come campioni di CQ non sono materiali biologici freschi, ma sono materiali trattati (per esempio liofilizzati) per assicurarne una lunga conservazione, e questo può determinare nei materiali di controllo comportamenti difformi rispetto a quelli dei sieri freschi dei pazienti (un problema noto come “mancanza di commutabilità”). Per un approfondimento di questi temi riporto (anche se è un pò datato, rimane sostanzialmente valido) il documento sul “Controllo di qualità nel laboratorio clinico” pubblicato nel 1995 con alcuni colleghi della SIBioC. La parte relativa alla biochimica clinica, che fa la parte del leone nell’utilizzo del CQ basato sul controllo statistico di qualità, è trattata ampiamente nel già citato documento su “Il controllo di qualità interno nel servizio di medicina di laboratorio” allegato al DDG 32856 della Regione Lombardia. Se quello sopra riportato lo potremmo definire come l'approccio classico al controllo di qualità nel laboratorio clinico, in realtà con il passare degli anni gli strumenti di gestione si sono progressivamente affinati. Così a metà degli anni '90 sono comparse le carte OPS, che consentono, sulla base della modellizzazione dell'errore analitico proposta da J. O. Westgard, di adattare le regole di controllo alle specifiche situazioni analitiche. Nell'area di download trovate il programma per PC che avevo scritto allora. Per un approfondimento del tema potete consultare direttamente il documento “Le funzioni di potenza e le carte OPS” che avevo preparato per illustrare il programma, che contiene una spiegazione delle basi teoriche e delle tecniche impiegate. Noto fino al 2005 come NCCLS (National Committee for Clinical Laboratory Standards), l'attuale CLSI (Clinical and Laboratory Standards Institute) è il massimo riferimento istituzionale anche nel campo del CQ. Le linee guida per l'implementazione dell'approccio al CQ introdotto da Westgard le potete trovare nel documento del CLSI: C24-A3 Statistical Quality Control for Quantitative Measurement Procedures: Principles and Definitions; Approved Guideline — Third Edition (2006). Un approccio ancora più attuale, è quello del CQ basato sulla gestione del rischio, la cui linea guida è stata pubblicata nel 2011 dal CLSI:EP23-A Laboratory Quality Control Based on Risk Management; Approved Guideline (2011). Il CQ basato sulla gestione del rischio, secondo quanto afferma Westgard, è destinato (almeno negli USA) a portare rapidamente alla cessazione dell’utilizzo di quella forma di CQ che da noi è nota come VEQ (Valutazione Esterna della Qualità) come strumento per il controllo della qualità analitica. Personalmente ritengo che anche noi dovremmo seguire questa strada. Registrandovi al sito di J. O. Westgard (la registrazione è gratuita) potete accedere alla migliore raccolta di documenti e articoli sul tema del CQ disponibile sul web. Va da sè che se in un laboratorio di analisi cliniche (per esempio) i campioni di due pazienti possono essere scambiati, o se un risultato può essere trascritto in modo errato, la qualità analitica dedotta dal controllo statistico di qualità può essere grossolanamente inapplicabile ad uno specifico campione. Per questo il controllo di qualità è un buon indicatore della qualità dei risultati ottenuti sui materiali biologici dei pazienti solamente se inserito in un contesto organizzativo che assicura il controllo di tutte le variabili di processo. Così oggi in un moderno laboratorio clinico due campioni non possono essere scambiati in quanto il contenitore identificato al momento del prelievo con un codice a barre viene riconosciuto automaticamente e senza possibilità di sbagli dallo strumento che effettua l'analisi. E il relativo risultato non può essere trascritto in modo errato, perché dallo strumento viene trasferito direttamente nel referto. Nel corso di un paio di decenni controllo di qualità e gestione del contesto organizzativo fortunatamente sono andati evolvendo molto in fretta e congiuntamente, e assicurano oggigiorno risultati delle analisi di laboratorio affidabili e disponibili in tempi molto rapidi. ******************************** Nota: il diagramma PDCA è tratto da Karn G. Bulsuk (http://www.bulsuk.com)
|
|
|
|
|
|
|
|
Ultimo aggiornamento: 20 febbraio 2023

NOTA SUI COLLEGAMENTIALLE FONTI BIBLIOGRAFICHE La maggior parte dei collegamenti ad articoli scientifici riportati nel sito fa riferimento a riviste online che forniscono gratuitamente l’articolo originale. In alcuni casi è necessario registrarsi sul sito per avere libero accesso agli articoli: questo accade per esempio con il BMJ. Quando i collegamenti fanno riferimento a fonti bibliografiche a pagamento, chi non ha sottoscritto un abbonamento con la rivista potrebbe vedere comparire un messaggio del tipo “access forbidden”, ma il più delle volte vedrà comparire una pagina che consente di acquistare online l’articolo originale.
Programma di statistica Ministat (versione per Windows)

Programma di statistica Open Source R(per Linux, Mac OS X e Windows)
Manuale Merck di diagnosie terapia
L’articolo da non perdere...
Errori congeniti del metabolismo
I migliori libri del mese Leonard Mlodinow La passeggiata dell’ubriaco. Le leggi scientifiche del caso.Rizzoli Editore, 2009, pp. 294ISBN: 17034081
OpenOffice, la suite Open Source (per Linux, Mac OS X e Windows)
ebooks... Mauss, Berg, Rockstroh, Sarrazin, Wedemeyer.Hepatology - A clinical textbook. 10th Edition - 2020
Le lettureconsigliate
Atlante di anatomia del Bock
Tavole metaboliche
Informazioni: info@bayes.itScrivimi: webmaster@bayes.it
NOTA LEGALE L’interpretazione dei risultati delle analisi di laboratorio deve essere effettuata esclusivamente dal medico e alla luce dei dati clinici.Questo sito ha uno scopo esclusivamente educativo e formativo. Pertanto le informazioni in esso contenute possono essere utilizzate esclusivamente a scopo didattico, e anche in questo caso sotto la responsabilità personale di chi le utilizza, sia per sé stesso sia per terzi.Le informazioni contenute in questo sito non possono e non devono essere utilizzate né a scopo diagnostico, né a scopo prognostico, né a scopo terapeutico, né per qualsiasi attività che abbia un impatto sia diretto sia indiretto sullo stato di salute di un individuo o di più individui.Nessuna responsabilità può essere imputata all’autore per danni diretti o indiretti e di qualsivoglia natura che potrebbero essere causati a sé stessi o a terzi a causa di errori, imprecisioni, omissioni, interpretazioni o utilizzo dei contenuti di questo sito o dei siti cui esso fa riferimento.
E ora che i test genetici sono alla portata di tutti?Con meno di mille euro è possibile comprare un test genetico su Internet: si manda un piccolo campione di cellule e poi si aspetta la risposta. Ma... a che cosa serve la risposta? Un dossier di Marika De Acetis dall’Archivio storico del sito www.torinoscienza.it
[Home] [Errori cognitivi] [Epistemologia] [Teorema di Bayes] [Decisioni mediche] [Le basi biochimiche][Analisi tradizionali] [Analisi genetiche] [Qualità in laboratorio] [Statistica e laboratorio][Storia delle medicina] [Download] [Link] [Bacheca] [FAQ] [Chi sono]
Attualità in tema di eGFR:
I migliori libri del mese Giovanni Federspil Logica clinica. I principi del metodo in medicina.McGraw-Hill, 2004, pp. 368ISBN: 88 386 2984-6
Atlante di virologia
Dal settembre 2008oltre 400 000 visitatori
ebooks... M. BesozziErrori cognitivi, probabilità e decisioni mediche. Fate click sul titolo o scaricate il testo su tablet o smartphone con il codice a barre riportato qui sotto. 

Atlante dei protozoi intestinali
Atlante di citologia e istologia
Statistica e grafica con R
Espressione dei risultati nel laboratorio di chimica clinica
Pathology outlines
Atlante di anatomia del Gray
Atlante di ematologia
Atlante di parassitologia
Micobatteriologia clinica
Concetti, metodi e strumenti per una
buona informazione
ebooks... M. BesozziStatistica e grafica con R Fate click sul titolo o scaricate il testo su tablet o smartphone con il codice a barre riportato qui sotto. 

I migliori libri del mese Luigi Tesio I bravi e i buoni.Perché la medicina clinica può essere una scienza.Il Pensiero Scientifico Editore, 2015, pp. 216 ISBN: 978-88-490-0538-7
Gli inganni della correlazione:
Storia delle unità di misura
Questo sito è stato archiviato ed è reso disponibile esclusivamente come memoria storica. Se le parti del sito riservate al teorema di Bayes restano concettualmente valide, declino invece qualsiasi responsabilità per la lenta ma inevitabile obsolescenza dei restanti contenuti dovuta alla comparsa di nuove analisi di laboratorio, di progressi nelle analisi genetiche, di link interrotti, e quant’altro.


















